是指在PCR反应体系中加入荧光基团,利用荧光信号的变化实时监测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的关系对起始模板进行定量分析。该方法具有专属性强、灵敏度高、准确度高等优点,因而被广泛应用于药物DNA残留及病原学定性检测等领域。用的荧光化学分类有染料法和探针法。其中,探针法可以更加精确地对需要检测的DNA片段进行染色,一般情况下,探针法的特异性更高。
荧光定量PCR有着高灵敏性、高精确度、方便省时等特点,他可以在短时间内,将一个微量的特种DNA扩增到一个足以监测到的数量级。由于在体内达到一定数量级会造成生物体死亡,这就要和在动物体内的病原微生物赛跑,以达到早发现,早处理的目的。也正是由于荧光定量PCR的极高灵敏性,极其容易受到污染,所以对实验室的配置和操作人员的要求更为苛刻。在此和大家分享一些经验和教训。


一、荧光定量PCR实验室的分区
对于有条件的实验室要对实验区域进行合理分区,按顺序分别为试剂配置区、样品处理区、核酸抽取和加样区、扩增区等,并且按要求设置正负压。实验人员在实验中要保持单向性,即实验由配液区开始,经样品处理区、到扩增后处理区结束,不可反向而行。每个实验区域里使用专用的无菌服,专用的微量移液器等实验仪器和设备。
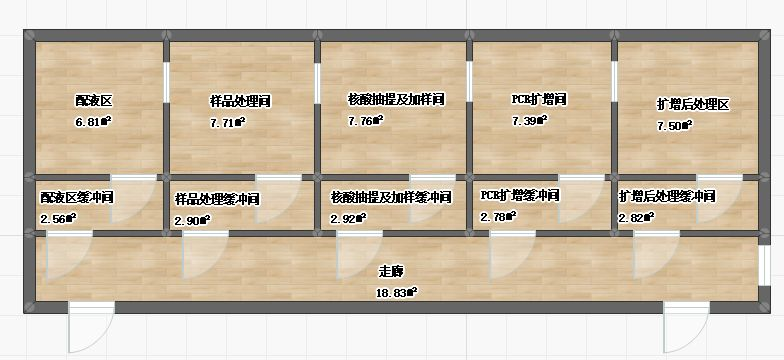
1、配液区:配置缓冲液、生理盐水、反应液及阴性对照,该区域内的移液器要专用,气压为正压模式,防止外源性DNA污染。
2、样品处理区:该区域气压为负压模式,防止病原扩散,确保生物安全。
3、核酸抽取和加样区:将处理好的样品按试剂盒说明书进行核酸抽提,该区域为负压模式,防止核酸向外扩散。(有条件的实验室还可以将核酸抽取区和加样区分开)
4、扩增区:把加样后的荧光定量PCR管按顺序放进荧光定量PCR仪中,按设定好的程序进行扩增,该区域气压为负压模式。
5、扩增后处理区:反应后PCR管不可在实验区域内开启。实验中牵涉到的有毒有害及有污染的样本和物品必须严格按照生物安全相关规定处理。
二、实验过程注意事项
1、配制反应液注意事项
(1)试剂置于冰上放置,注意避免强光照射,防止荧光淬灭。
(2)所有的试剂要加到管底,尽量不要加到管壁,反应体系配制完毕后低速离心数秒,避免产生气泡。

2、实验过程注意事项
(1)分样前,所有的样品进行瞬离,可防止开盖时由于盖上粘有液体而增加污染的风险。
(2)进行样品处理时,尽量使用较长的吸头取样,防止因移液器的污染而导致样品间的交叉污染。
(3)加样时关闭生物安全柜里的照明,在冰盒上操作,尽量避免直射光源的照射下进行。
(4)条件允许,尽量使用一次性带滤芯移液枪吸头,使用非带滤芯的吸头的时候,移液器尽量不要使用最大量程移液,移液器尽量避免使用第二档,防止打出气泡,回弹污染移液器。
(5)加样后将荧光定量PCR管瞬时离心,不要在荧光定量PCR管上做任何标志,不能用手碰到PCR管盖上的采光部位,以免影响实验的准确性。
(6)荧光探针应避光保存,加入核酸模板后应尽快上机,以防探针淬灭。

3、其他注意事项
(1)实验室的通风是防止污染的非常重要的方法,不要指望污染物自行降解,而是应该设法把污染物从实验室赶走。最早的实验室设计都是一个闭风的状态,现在都变成了一种过滤通风的状态。
(2)实验结束后,实验中用到的仪器设备,只要不怕水和腐蚀的,都用有效氯消毒液进行浸泡或擦拭,最后用清水洗净或擦净的方法来清洁,操作台紫外线照射。
(3)实验中用到的吸头、离心管和生理盐水都要预先包装好,高压消毒,需烘干的要烘干后再使用。
(4)实验人员在操作过程中戴上口罩,戴上两种手套,里层为透明一次性手套,外层为胶手套,既有利于防止污染,而且便于脱下。实验时,最好戴上一次性帽子,防止头发带来的污染。
实时荧光定量PCR对操作要求很高,而且花费也高,为了得到准确的结果,严格控制实验过程中的污染和掌握实验过程中的操作细节尤为重要。